R. Wu, Y. Li, M. Shen, X. Yang, L. Zhang, X. Ke, G. Yang, C. Gao, Z. Gou, S. Xu, Bone tissue regeneration: The role of finely tuned pore architecture of bioactive scaffolds before clinical translation, Bioactive Materials. 6 (2021) 1242–1254. https://doi.org/10.1016/j.bioactmat.2020.11.003.
Spatial dimension of pores and interconnection in macroporous scaffolds is of particular importance in facilitating endogenous cell migration and bone tissue ingrowth. However, it is still a challenge to widely tune structure parameters of scaffolds by conventional methods because of inevitable pore geometrical deformation and poor pore interconnectivity. Here, the long-term in vivo biological performances of nonstoichiometric bioceramic scaffolds with different pore dimensions were assessed in critical-size femoral bone defect model. The 6% Mg-substituted wollastonite (CSi-Mg6) powders were prepared via wet-chemical precipitation and the scaffolds elaborately printed by ceramic stereolithography, displaying designed constant pore strut and tailorable pore height (200, 320, 450, 600 μm), were investigated thoroughly in the bone regeneration process. Together with detailed structural stability and mechanical properties were collaboratively outlined. Both μCT and histological analyses indicated that bone tissue ingrowth was retarded in 200 μm scaffolds in the whole stage (2–16 weeks) but the 320 μm scaffolds showed appreciable bone tissue in the center of porous constructs at 6–10 weeks and matured bone tissue were uniformly invaded in the whole pore networks at 16 weeks. Interestingly, the neo-tissue ingrowth was facilitated in the 450 μm and 600 μm scaffolds after 2 weeks and higher extent of bone regeneration and remodeling at the later stage. These new findings provide critical information on how engineered porous architecture impact bone regeneration in vivo. Simultaneously, this study shows important implications for optimizing the porous scaffolds design by advanced additive manufacture technique to match the clinical translation with high performance.
大孔支架中孔隙的空间维度和互连性在促进内源性细胞迁移和骨组织生长方面具有特别重要的意义。本文在临界尺寸的股骨缺损模型中,评估了不同孔径的非定向生物陶瓷支架的长期体内生物学性能。通过湿化学沉淀法制备了6%的Mg-取代硅灰石(CSi-Mg6)粉体,并通过陶瓷立体光刻技术打印了支架,孔径符合设计尺寸(200、320、450、600 μm)。μCT和组织学分析均表明,200μm支架在整个阶段(2-16周)骨组织生长迟缓,但320μm支架在6-10周时多孔结构中心有可观的骨组织,16周时成熟的骨组织均匀侵入整个孔网。450μm和600μm支架在2周后促进了新组织的生长,后期的骨再生和重塑程度更高。这些新发现为工程多孔结构如何影响体内骨再生提供了关键信息。同时,该研究显示了通过先进的增材制造技术优化多孔支架设计,以匹配临床转化的高性能的重要意义。
- 设计了宽度不同高度相同的互连孔支架
- 大多数现有研究都是针对体内早期骨再生阶段,而本文研究了整个骨修复阶段
Introduction
支架是骨组织工程研究的核心(centerpiece),其设计和性能至关重要。支架的化学成分和孔结构在治疗承重骨缺损中尤为重要(be of particular/paramount importance)。支架的孔隙率、孔径和孔的互连性会影响营养物质的运输,影响组织再生。
一些研究表明,孔径和互连性可能决定血管生成和促进骨生长。但是大多数研究都是在体内的早期阶段进行的,缺少孔径在整个骨修复阶段的研究。另外,传统制造技术表现出难以定制复杂支架形状和内部孔结构、互连性差等缺点。
近年来,计算机辅助设计(computer-aided design, CAD)和增材制造(additive manufacture, AM)技术已经显著增强了制造多孔支架的能力。可以使用陶瓷立体光刻技术(ceramic stereolithography)实现具有精确定制孔径的多孔支架。
为了理解孔尺寸对骨组织生长的影响,必须保持生物活性支架的多孔结构能维持稳定,避免快速的生物降解。烧结的掺杂镁的硅酸钙(Mg-doped calcium silicate, CSi-Mg)最近得到证实可以缓慢降解。
本文假设长期的体内植入研究有助于正确地得到孔结构对骨组织生长的影响。基于该假设,从μCT重建和临界骨缺损模型分析了方形孔支架。根据得到的数据,本文提出了两个设计支架和评估骨生长的参数。
最后一段结构可借鉴:
To clarify the above concerns, it is reasonable to postulate that a long-term implantation study in vivo may be helpful for capturing the whole bone repair stages and correctly conclude the pore architectures do influence the progress of bone tissue growth. Based on this hypothesis, the porous scaffolds with cubic pores were analyzed both from their pore architectures based on 3D μCT reconstruction and from criticalsized bone defect model studies. On the basis of the data obtained, we proposed two new indices for the design of pore parameters of 3D printing bioceramic scaffolds and assessment of bone tissue growth in the entire scaffolds.
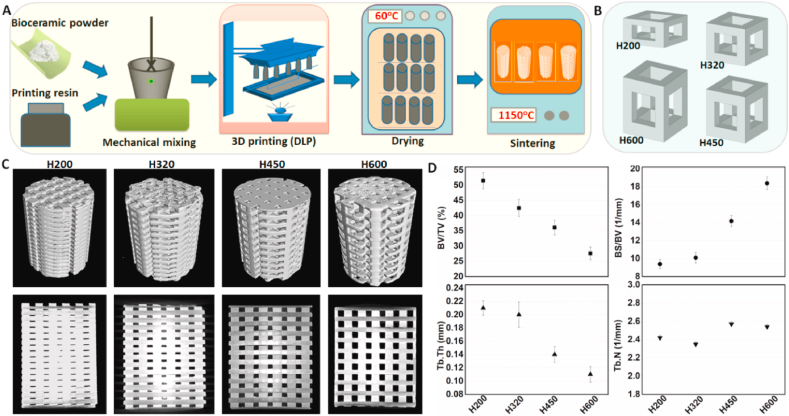
Results
1.支架表征:
SEM显示了尺寸和形态。为了评估结构稳定性,测量了支架的应力应变曲线和峰值强度。不同参数支架的应力-应变曲线在压缩载荷下呈现出相似的响应。测量了支架在浸泡在Tris缓冲液中的质量下降程度。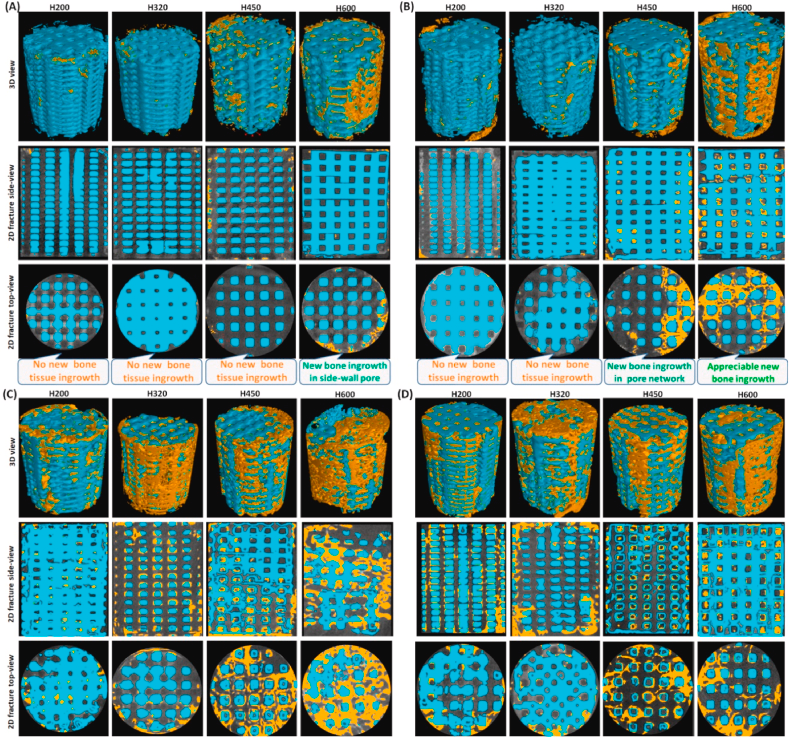
2.体内骨再生评估
2.1宏观评估
轻度炎症反应主要发生在最初的两周内。4周后,愈伤组织的形成部分覆盖了植入物表面的某些部分,而10周后,组织良好的愈伤组织完全覆盖了植入物的整个表面。
放射学检查显示支架在术后2–16周表现出不同的生物降解进程。在4周和6周的早期阶段,用H450和H600处理的缺损修复效果最好,最坏的情况是用H200填充的骨缺损。10周后,H200支架很容易与宿主骨组织分开。这是因为H200植入物的孔隙率最低,并且降解较慢。相比之下,H600生物陶瓷支架在术后4-16周内显示出非常快的体内生物降解。而且,在16周后通过X射线检查,几乎没有发现H320和H450两组之间的材料残留差异。这表明侧壁方向上的大孔径可能有助于CSi-Mg6的新骨组织向内生长和生物降解。
2.2 体内μCT检查
图4(A,B)显示了术后2周和4周的股骨骨缺损的2D / 3DμCT图像。从纵断面和横断面看,在早期所有植入物都保持结构完整(支架显示为蓝色)。2D μCT显示,新的骨组织在2周后开始渗入H600支架的外周孔隙。
通道孔中的分布从外围到中心逐渐变化,这取决于孔径和与原生骨/支架界面的距离。H200和H320组在4周后显示出非常有限的新骨组织,而某些骨组织可以生长到H450和H600支架的第二通道孔中。
随着修复时间延长至6周,H450和H600组中有大量新骨组织侵入大孔结构(图4C),甚至导致10周后完全桥接骨缺损(图4D)。对于H200和H320组,在6周后一些新骨组织开始填充支架,并且此时H320组的成骨更多。
在植入后期,通过μCT评价骨组织平行于支架纵轴的空间分布,将支架划分为三个主要区域(Ø 5.5、3.5、1.5 mm)。H200组的骨形成在不同区域显得不太均匀,在中心区(Ø 1.5 mm;图5A)没有或几乎没有观察到。然而,对于用H320支架填充的缺损,新的骨组织延伸到植入物的中心区域,贯穿整个多孔支架(图5B)。值得注意的是,与H320组相比,H450和H600组在中心大孔中的骨组织成熟度较低(图5C和D)。
BV/TV (bone volume versus the total volume of defect)
Tb·N (Trabecular Numbers)
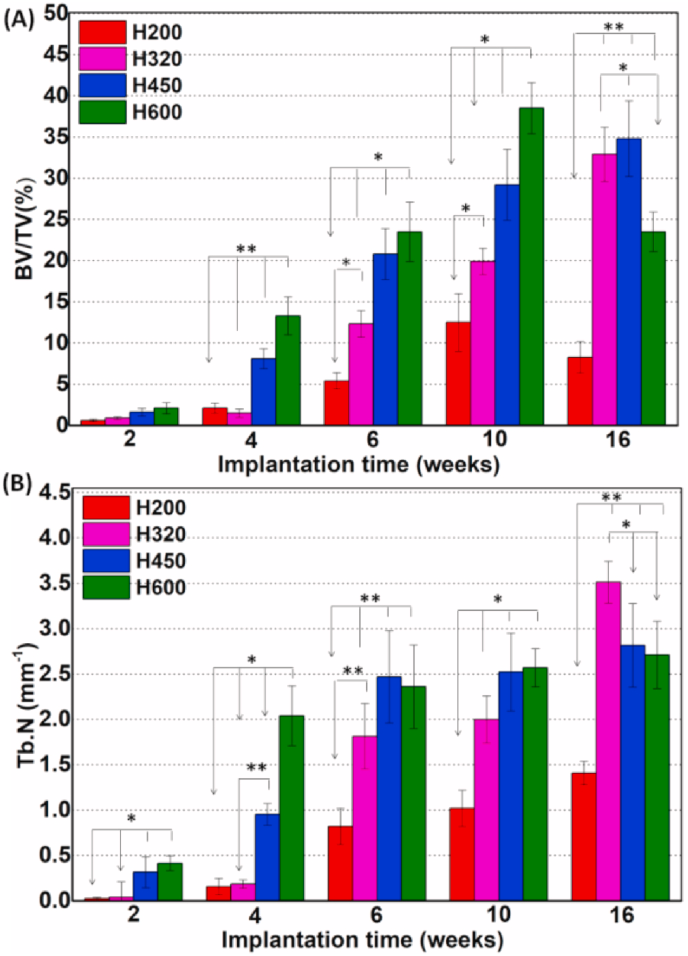
另一方面,定量的BV/TV和Tb-N值与上述观察结果一致(图6),分别反应了骨缺损中新骨组织的数量和骨小梁密度。H450组和H600组在2-10周的BV/TV数据要高得多,这意味着骨组织的持续生长,导致Tb-N数据增加,从而达到高效的骨修复(图6B)。但有趣的是,H600组的BV/TV数据从10周到16周呈明显下降趋势。相比之下,H200组的BV/TV和Tb-N数据增长极为缓慢,表明新的骨组织难以通过支架的小侧壁孔形成。而H320组在6-16周内测得BV/TV和Tb-N值稳步上升,16周时甚至优于H450和H600组。
2.3 体内组织学评估
组织学染色分析旨在考察大孔支架与小孔支架相比是否具有优越性。将PMMA包埋骨标本横向切开后,在光学显微镜下很容易观察到支架在圆形骨缺损周围的横截面,McNeal染色图像显示出更清晰的多孔网络和组织/支架界面。在不同的侧壁孔径下,支架的新骨生长程度不同(图7)。H200支架不能为新骨组织的生长提供多孔基质,4周时支架内主要是非钙化组织(图7A)。对于H320支架,成骨细胞迁移到周围的孔隙中,但在早期只观察到非常有限的骨样组织形成(图7B)。然而,组织学分析(图7C和D)连同μCT切片(图4B)揭示了原生骨和多孔生物材料之间的连接。值得注意的是,新骨组织从支架外围渗透到H450和H600支架中,显示出预期的新骨组织和生物陶瓷支架之间的附着和整合。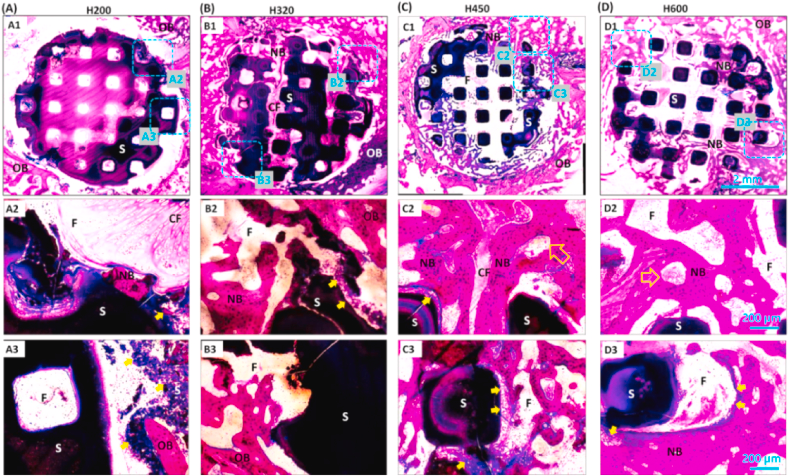
6-16周后,McNeal染色分别证实了组织-材料界面的矿化、新骨生长以及组织学演变(图8A)。观察到H450组从支架外围到中心区保持了稳定的成骨反应,最终在16周时,在整个支架结构中获得了与H600组近似的可观的成熟骨组织。然而,H200和H320组的骨形成速度较慢,这可能是由于支架中相互连接的小孔的限制,尤其是前者在10周后新矿化组织较少。另一方面,由于H450和H600组中陶瓷支柱的明显生物降解和手术部位的完全骨结合,骨缺损边缘不易识别。
同时,BS/TS(%)的定量形态分析也证实,H450组和H600组在早期与H200组和H320组相比具有明显的成骨能力,而后期在16周时,新骨形成出现退化(图9)。在整个植入过程中,H450组的BS/TS值最高。同时,H320组的骨再生能力稳步上升,但后期不如H600组。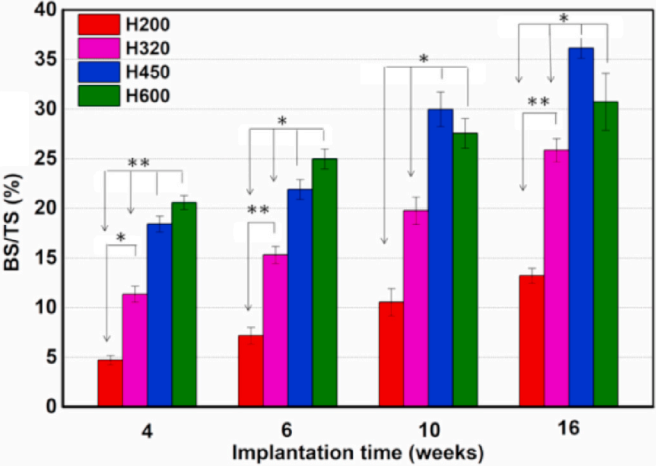
2.4 体内相转化化学成分评价
采用SEM/EDS分析,分别检测6周和16周后钙硅酸盐支架向磷灰石类骨矿物的转化过程和元素分布。
discussion
-与孔径相比,支架孔隙率对加速或延迟体内早期骨再生效率影响较小
In comparison with the pore size, the scaffold porosity is less critical for accelerating or delaying the early-time osteoregenerative efficiency in vivo. [*]
P. Kasten, I. Beyen, P. Niemeyer, R. Luginbuhl, M. Bohner, W. Richter
Porosity and pore size of beta-tricalcium phosphate scaffold can influence protein production and osteogenic differentiation of human mesenchymal stem cells: an in vitro and in vivo study
Acta Biomater., 4 (6) (2008), pp. 1904-1915
-生物相容性和孔结构共同组成了生物材料的传导性
It has long been believed that surface biocompatibility and pore structures constitute to the osteoconduction of biomaterials.
总之,本文通过陶瓷立体光刻技术开发了具有精确孔结构的生物活性陶瓷支架,并系统地评估了体外孔结构参数和生物降解行为以及体内骨再生效果。Dilute Mg substitution in wollastonite有助于显着提高机械性能,有利于结构稳定性;同时,由于孔隙高度和骨传导性能的显着差异,四种类型的支架在成骨效率方面的最精细差异出现在早期和晚期。目前的实验结果首次提供证据表明,生物陶瓷支架中精确调节的孔结构具有略微不同的生物降解率,在增强骨修复方面表现出极其有趣的生物学特性。因此,这种操纵生物材料(微)结构的通用 CAD 模型优化过程提供了一种生产具有合理设计的生物活性支架的方法,以实现有前景的临床转化。