M. Wang, N. Yang, A review of bioregulatory and coupled mechanobioregulatory mathematical models for secondary fracture healing, Med. Eng. Phys. 48 (2017) 90–102.
Monan Wang: Mechanical & Power Engineering College, Harbin University of Science and Technology, Harbin, China
骨折愈合是一个复杂的生物过程,涉及许多细胞和分子过程。在骨折愈合期间,生化信号在促进愈合过程中起调节作用。尽管已经进行了许多研究骨折愈合的实验,但是仍有机制没有清楚地理解。近几年已经建立了许多数学模型和计算模拟来研究骨折的愈合过程。这些模型为研究细胞行为、机械刺激和生化信号之间的相互作用提供了强大的工具,并有助于设计新的治疗策略。但是,大多数数学模型都集中在机械刺激的作用上,很少有模型考虑生化信号在骨折愈合过程中的重要作用。在这篇综述中,我们首先强调骨折愈合过程中生化信号的重要性。然后,介绍了现有的生物调节和耦合机械生物调节模型。最后,讨论了一些局限性和可能的解决方案。
本文是一篇综述,总结了耦合和力学调节和生物调节的骨折愈合模型。
主要分为三部分:
- The bone healing biology and biochemical signals (growth factors and oxygen) that has been established in the previous mathematical models.
- The current bioregulatory and coupled mechanobioregulatory healing models. Their modeling process, actual mathematical models and their advantages and disadvantages are outlined.
- The limitations of these current healing models and focused on the future trend of mathematical healing models and their potential contributions to real world clinical applications.
In the US, the cost of osteoporosis related fractures reached 17 billion dollars in 2005 and it is estimated that by 2025, the annual costs will rise by 50%.
The role of biochemical signals in fracture healing
Primary healing and secondary healing are known as two healing types according to their difference in gap size. 骨折间隙较小时发生primary healing,secondary healing持续时间更长,过程也更复杂,本文主要关注secondary healing.
From a temporal point of view, the healing process is generally divided into the following four phases: the inflammatory phase, the soft callus phase, the hard callus phase and the remodeling phase.
- Inflammatory phase: 相关生长因子包括 interleukin-1 (IL-1), interleukin-6 (IL-6), insulin-like growth factors (IGFs), transforming growth factors-betas (TGF-s), platelet-derived growth factors (PDGFs) and bone morphogenetic proteins (BMPs). 间充质干细胞开始从周围骨膜中迁移到这一区域,形成愈伤组织
- Soft callus phase: 间充质干细胞根据生长因子、血管和氧条件开始分化,分为两种情况:1. 膜内骨化ossification 靠近皮质骨部分氧和营养供应充足,MSC直接分化为成骨细胞,形成编织骨(woven bone)。2. 软骨形成 chondrogenesis 骨折中心区域血管受损氧含量低,间充质细胞分化为软骨细胞。
- Hard callus phase: 发生软骨内骨化 endochondral ossification
- Modeling phase: 编织骨被层状骨替代,多余的愈伤组织被吸收
| 生化信号 | 功能 | 参与阶段 |
|---|---|---|
| TGF-β | -对巨噬细胞最有效的化学吸引剂 | -在炎症期微弱表达 |
| -促进间充质干细胞向软骨细胞或成骨细胞的分化 | -在软愈伤组织阶段强烈表达 | |
| -调节软骨基质的钙化并刺激成骨细胞活动 | -在硬愈伤组织阶段强烈表达 | |
| -抑制成骨细胞的分化和矿化 | ||
| -抑制成骨细胞的产生和活性 | ||
| -增加骨骼和软骨的产生 | ||
| PDGFs | -开始骨折修复和骨愈伤组织形成 | -在炎症期微弱表达 |
| -刺激间充质干细胞增殖 | -在软愈伤组织阶段强烈表达 | |
| -促进软骨形成和膜内骨化的过程 | -在硬愈伤组织阶段强烈表达 | |
| -促进结缔组织细胞的增殖 | ||
| -刺激I型胶原蛋白并调节血流量 | ||
| BMPs | -激活骨祖细胞的分化,上调成骨细胞的增殖 | -在炎症期表达 |
| -调节间充质干细胞分化为成骨细胞和软骨细胞 | -在软愈伤组织阶段表达 | |
| -促进或阻碍血管生成 | -在硬愈伤组织阶段表达 | |
| FGFs | -促进血管生成的形成 | -在炎症期表达 |
| -一种软骨细胞的趋化剂和有丝分裂原,并调节分化 | -在软愈伤组织阶段表达 | |
| -在硬愈伤组织阶段表达 | ||
| IGFs | -促进骨祖细胞的增殖 | -在软愈伤组织阶段表达 |
| -促进软骨基质的合成 | -在重塑阶段表达 | |
| -帮助骨骼的形成;调节破骨细胞的功能 | ||
| -促进血管生成 | ||
| VEGF | -上调血管新生并促进内皮细胞增殖 | -在软愈伤组织阶段表达 |
| -在硬愈伤组织阶段表达 | ||
| 氧 | -为细胞活动产生ATP | -在炎症期表达 |
| -对酶活性很重要 | -在软愈伤组织阶段表达 | |
| -调节血管生成并促进骨再生 | -在硬愈伤组织阶段表达 | |
| -对细胞增殖和分化很重要 | -在重塑阶段表达 |
Mathematical healing models regulated by biochemical signals
从六个数据库中选取符合条件的文章,耦合生物调节和机械调节的愈合模型,排除会议论文、摘要、综述。最终选出八篇。
模型的一般结构
一般采用偏微分方程,描述不同细胞群(内皮细胞,成纤维细胞,软骨细胞,成骨细胞)、调节因子(生长因子和氧等生物调节因子以及机械调节因子)。细胞的数量变化用细胞迁移、增殖和分化等细胞活动表示。
生长因子调控的愈合模型
The first mathematical healing model regulated by growth factors was presented by Bailón-Plaza and van der Meulen.[1]
七个连续变量模拟MSC、软骨细胞、成骨细胞的增殖和分化,以及细胞外基质的合成和降解。但是没有包含血管生成。
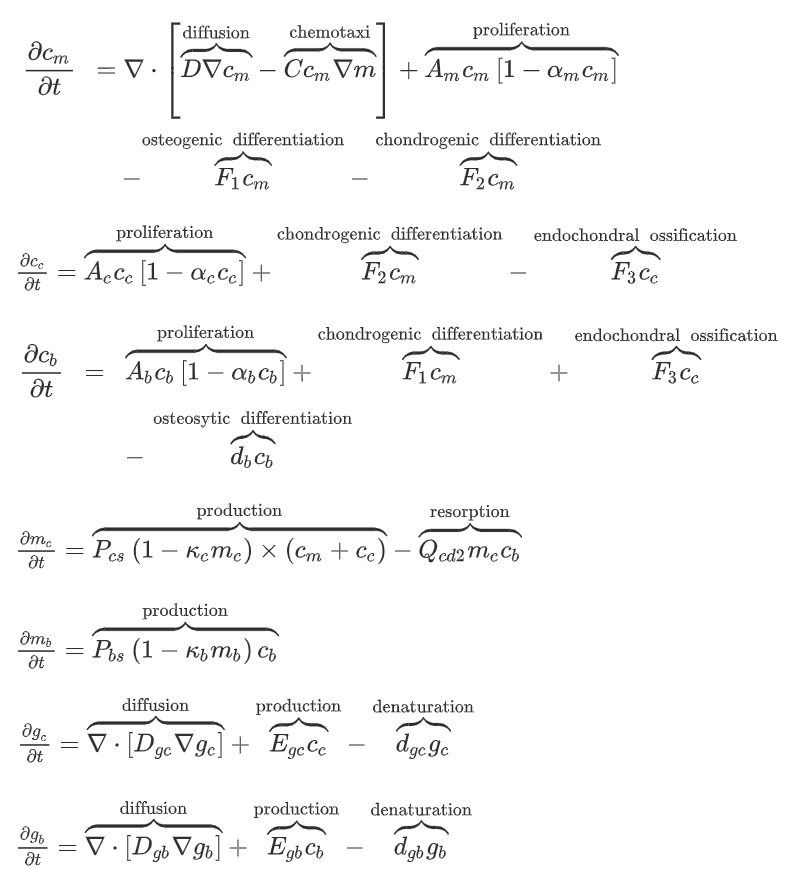
Geris et al. [2] made some extensions based on the model presented by Bailón-Plaza and van der Meulen.
增加了两个成纤维细胞变量,并在模拟细胞迁移时增加了趋化性。另外增加了血管生成的模拟。
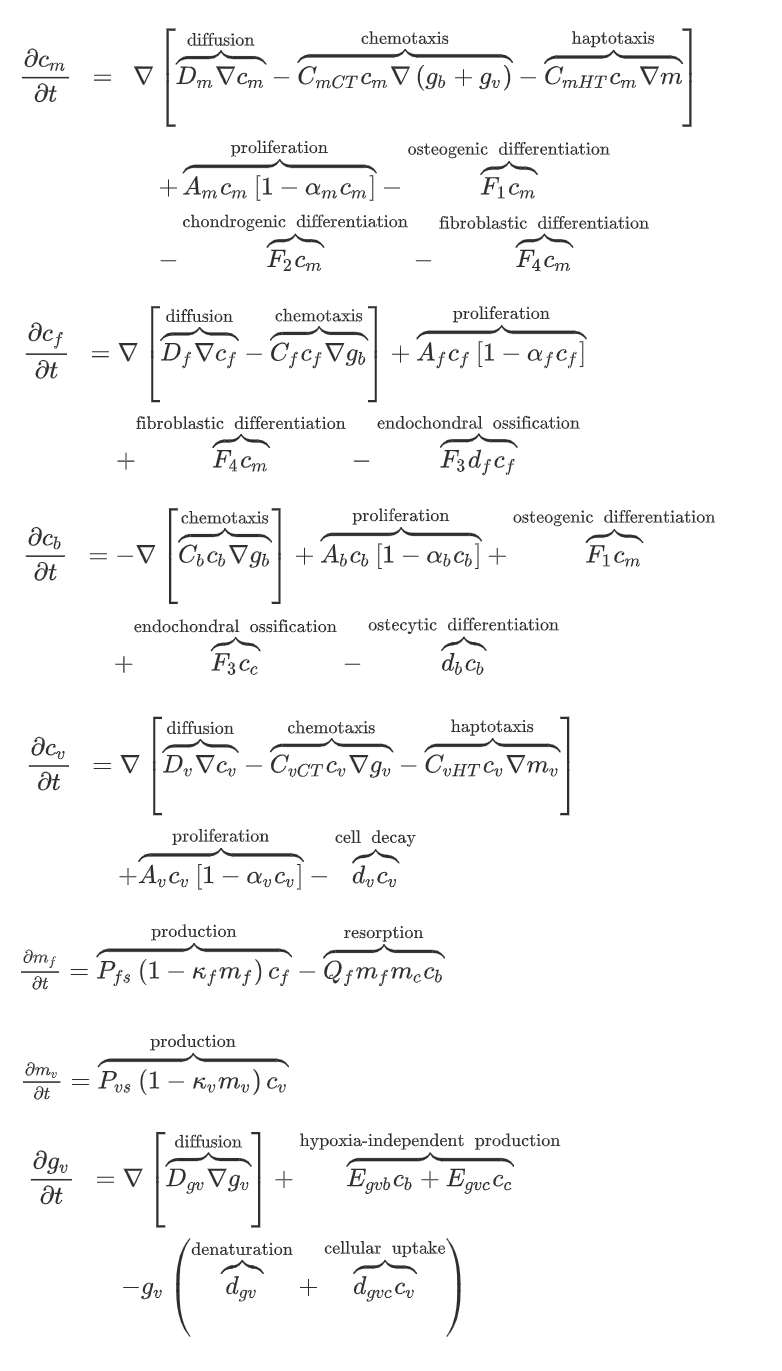
但是,这里的血管生成是用连续的数学模型模拟的,不符合血管离散的性质,因此Peiffer [3]
等人用离散变量模拟血管,包括血管生长、分支和吻合。同时引入了一个变量n,模拟氧气和养分的浓度。

The major advantage of this model is that angiogenesis can be corroborated by comparison with experimental observations. However, the angiogenesis process was still simulated in a phenomenological way.
Carlier [4] [5]提出了新的多尺度的数学模型来描述的生物化学信号(生长因子和氧)、细胞和血管之间的相互作用。
在intracellular层面,考虑了VEGFR-2, Notch1, DII4, active VEGFR-2, active Notch1, effective active VEGFR-2, effective active Notch1 and actin对内皮细胞生长的影响。在cellular层面,模拟了血管网的分芽、生长和吻合。在tissue层面,对骨折愈合中的膜内骨化和软骨内骨化进行了建模。
结合机械刺激的生物调节愈合模型
Bailón-Plaza和van der Meulen [6]将机械刺激的影响加入之前提出的生长因子调控模型[1]中 。They used deviatoric strains and dilatational strains as the mechanical stimuli on the ossification. Through a comparison with in vivo experiments [7], the simulation results showed that moderate, early loading and delayed or excessive loading had beneficial or adverse effects on the bone healing, respectively.
Geris等开发了一个数学建模框架[8],将机械刺激的影响纳入了生物调节模型[2]。Mechanical stimuli were integrated as parametric values into mechanical dependent activities such as angiogenesis, matrix and growth factor production, and cell proliferation and differentiation.
Challenges and current limitations of mathematical healing models
模型的固有局限性
在目前的模型中,chondrogenic growth factors用于调节间充质干细胞分化为软骨细胞,osteogenic growth factors用于调节间充质干细胞向成骨细胞的分化以及软骨内成骨细胞代替软骨细胞,Vascular endothelial growth factor 用于调节血管的形成。但是,有很多生长因子参与骨折愈合过程,并且这些因子并非彼此独立。不同生长因子之间的相互作用未纳入现有模型。
另外,现有模型中不包括不同细胞的许多瞬时状态。例如间充质干细胞的成骨分化经历了许多中间状态: osteoprogenitors, pre-osteoblasts, transitory osteoblasts, secretory osteoblasts and osteocytes。在体内,不同的细胞状态在骨折愈合过程中具有独特的功能。因此,有必要对这些中间单元状态进行建模。此外,缺乏中间细胞状态可能是与实验观察结果相比在数学模型中观察到更短愈合时间的原因之一。
纳入机械刺激
在组织水平上的机械刺激与在细胞水平上的机械刺激完全不同。另外,在组织水平上的机械刺激如何转化为细胞水平以及在再生组织中的细胞如何实现机械传感还没有被完全理解。
缺乏相关实验
在上述现有模型中,相关参数和材料特性均来自先前的研究。参数是通过一系列研究得出的,且并非全部来自同一物种,这可能会影响目标值。
Future aims and requirements of mathematical healing models
需要多尺度的数学模型
需要更多的实验数据,利用成像技术获取参数
需要将研究应用于临床
参考文献
[1] A. Bailon-Plaza, M.C. van der Meulen, A mathematical framework to study the effects of growth factor influences on fracture healing, J Theor Biol, 212 (2) (2001), pp. 191-209
[2] L. Geris, A. Gerisch, J.V. Sloten, R. Weiner, H.V. Oosterwyck, Angiogenesis in bone fracture healing: a bioregulatory model, J Theor Biol, 251 (1) (2008), pp. 137-158
[3] V. Peiffer, A. Gerisch, D. Vandepitter, H. Van Osterwyck, L. Geris, A hybrid bioregulatory model of angiogenesis during bone fracture healing, Biomech Model Mechanobiol, 10 (3) (2011), pp. 383-395
[4] A. Carlier, L. Geris, K. Bentley, G. Carmeliet, P. Carmeliet, H. Van Oosterwyck, Mosaic: a multiscale model of osteogenesis and sprouting angiogenesis with lateral inhibition of endothelial cells, PLoS Comput Biol, 8 (10) (2012), p. e1002724
[5] A. Carlier, L. Geris, N. van Gastel, G. Carmeliet, H. Van Oosterwyck, Oxygen as a critical determinant of bone fracture healing-a multiscale model, J Theor Biol, 365 (2015), pp. 247-264
[6] A. Bailn-Plaza, M. van der Meulen, Beneficial effects of moderate, early loading and adverse effects of delayed or excessive loading on bone healing, J Biomech, 36 (8) (2003), pp. 1069-1077
[7] A.E. Goodship, J. Kenwright, The influence of induced micromovement upon the healing of experimental tibial fractures, J Bone Joint Surg Br, 67 (4) (1985), pp. 650-655
[8] L. Geris, J.V. Sloten, H. Van Oosterwyck, Connecting biology and mechanics in fracture healing: an integrated mathematical modeling framework for the study of nonunions, Biomech Model Mechanobiol, 9 (6) (2010), pp. 713-724